多発性硬化症
更新日Martina Feichterは、インスブルックの選択科目の薬局で生物学を学び、薬用植物の世界にも没頭しました。そこから、今日まで彼女を魅了している他の医学的トピックまでそう遠くはありませんでした。彼女はハンブルクのアクセルシュプリンガーアカデミーでジャーナリストとして訓練を受け、2007年からhouseofgoldhealthproductsで働いています。最初は編集者として、2012年からはフリーランスのライターとして働いています。
houseofgoldhealthproductsエキスパートの詳細 すべてのhouseofgoldhealthproductsコンテンツは、医療ジャーナリストによってチェックされます。
多発性硬化症(MS、播種性脳脊髄炎)は神経系の慢性炎症です。その過程で神経構造が破壊され、さまざまな症状が現れます。病気はエピソードで進行することが多く、治癒することはできません。ただし、通常、投薬によって進行が遅くなる可能性があります。自己免疫疾患の多発性硬化症、その原因、症状、治療についてもっと読む。
この病気のICDコード:ICDコードは、医療診断のための国際的に認められたコードです。それらは、例えば、医師の手紙や仕事ができないことの証明書に記載されています。 H46G35
簡単な概要
- 多発性硬化症(MS)とは何ですか?中枢神経系(脳と脊髄)の慢性炎症性の非伝染性疾患。
- 原因:MSは自己免疫疾患と見なされており、その発症にはいくつかの要因が関与している可能性があります(遺伝的素因、感染症、喫煙、ビタミンDの不足など)。
- 症状:例:視覚障害、感覚障害(うずきなど)、痛みを伴う麻痺、歩行障害、持続的な倦怠感と急速な疲労感、膀胱排出障害、性機能障害、集中力の問題
- 検査:病歴の収集、身体的および神経学的検査、磁気共鳴画像法(MRT)、CSF診断、血液および尿検査、おそらく誘発電位
- 治療:投薬(再発療法およびフォローアップ療法用)、対症療法措置およびリハビリテーション(理学療法、作業療法、心理療法など)
- 予後:MSは不治ですが、その経過は正しく一貫した治療によってプラスの影響を受ける可能性があります(再発が少ない、病気の進行が遅い、生活の質が向上している)。
多発性硬化症とは何ですか?
多発性硬化症(MS)は、中枢神経系(CNS:脊髄および視神経を含む脳)の慢性疾患です。中枢神経系の再発または継続的な炎症を特徴としています。その結果、視覚障害や感覚障害、痛み、麻痺など、さまざまな苦情が発生します。これまでのところ、多発性硬化症の治療法はありません。病気の経過は、投薬によって好影響を受ける可能性があります。
多発性硬化症-進行性の形態
MSには3つの形式があります。
- 再発寛解型MS 再発寛解型MS、RRMS):これは最も一般的な形式です。 MSの症状はここにフレアで現れます。それらは攻撃間で完全にまたは不完全に退行します。
- 主に進行性MS プライマリプログレッシブMS、PPMS):最初から病気は着実に進行します-症状は継続的に増加します。ただし、孤立した再発もあります。
- 二次進行型MS 二次進行型MS、SPMS):再発寛解型MSから発生します。つまり、最初に再発したコースの後、症状は最終的に徐々に増加します(PPMSの場合と同様)-再発の有無にかかわらず。
これについて詳しくは、多発性硬化症-コースの記事をご覧ください。
臨床的に孤立した症候群(HIS)
「臨床的に孤立した症候群」(HIS)という用語は、医師が多発性硬化症のおそらく最初の臨床症状、つまり、MSと互換性のある神経機能障害の最初のエピソードと呼ぶものです。ただし、すべての診断基準が満たされているわけではないため、多発性硬化症は(まだ)診断できません。
しかし、その後の過程で、これは変化する可能性があります。つまり、臨床的に孤立した症候群は、実際の多発性硬化症、つまり再発寛解型MSに変わる可能性があります。しかし、それは起こる必要はありません!時々それは一回限りの推力にとどまります。
多発性硬化症:発生率
世界中で200万人以上が多発性硬化症を患っています。病気の分布は地域によって大きく異なります。 MSはヨーロッパと北アメリカで最も一般的です。
多発性硬化症は通常、20歳から40歳までの成人初期に始まります。しかし、それは子供や青年だけでなく、高齢者にも発生する可能性があります。最も一般的な形態である再発寛解型MSは、男性よりも女性の方が2〜3倍影響を受ける可能性があります。
多発性硬化症:症状
多発性硬化症は、症状が人によって異なる可能性があるため、「千の顔を持つ病気」とも呼ばれます-損傷によって影響を受ける神経構造によって異なります。
ほとんどの患者は最初は単一の症状しかありませんが、他の患者は最初から複数のMS症状があります。頻繁な最初の多発性硬化症の症状は、主に視神経の炎症(視神経炎)および/または皮膚の感覚障害による視覚障害です。この病気は、さらに/他の症状を伴って初めて現れることもあります。多発性硬化症のこれらの最初の兆候は、後で持続する可能性があります。さらに、他の症状がしばしばあります。
主なMS症状の概要
- 視覚障害:例えば、視神経の炎症(視神経炎)の結果としての目のぼやけ、視力の喪失および/または痛み、目の筋肉の調整障害の結果としての二重視力
- チクチクする、(痛みを伴う)異常な感覚(例:「ピンと針」)またはしびれなどの皮膚の感覚障害(感覚障害)
- 特に脚のけいれん様の痛みを伴う麻痺(痙縮)
- 運動協調性障害(運動失調)、歩行時または把持時の不安
- 倦怠感(著しい持続的な衰弱と急速な疲労感)
- 膀胱および/または腸を空にする際の障害(例:尿失禁、尿閉、便秘)
- 「不明瞭な」スピーチ
- 嚥下困難
- 対象を絞った意識的な動き(意図振戦)中の身体部分の不随意でリズミカルな震え(例:グラスに手を伸ばすときに手を振る)
- 不随意のリズミカルな眼振戦(眼振)
- 認知障害:注意力の低下、集中力の低下、短期記憶の障害
- 男性の射精の問題やインポテンス、女性のオルガスムの問題、男女の性的欲求の低下(性欲減退)などの性機能障害
- 痛み、例:頭痛、神経痛(例:三叉神経痛の形で)、腰痛
- めまい
- うつ病の気分、うつ病
多くの場合、過度の熱(非常に暑い天気、発熱、熱いお風呂など)は一時的にMSの症状を悪化させます。医師はこれをウートフ徴候と呼んでいます。
MSフレアアップ
ほとんどの人はMS症状を伴う再燃を経験します。 MSの再燃は、新しい神経障害の発生、または以前に発生した神経障害の再活性化として定義され、主観的に(患者によって)報告されるか、健康診断によって客観的に決定されます。これらの誤動作は、推力の定義に関する次の基準を満たす必要があります。
- それらは少なくとも24時間続きます。
- それらは最後のエピソードが始まってから少なくとも30日後に発生しました。
- 症状は、体温の変化(Uhthoff現象)、感染、またはその他の物理的または器質的な原因によって引き起こされたものではありません。
多発性硬化症:原因
多発性硬化症は一般的に自己免疫疾患として分類されます。これらは、免疫系の防御細胞が機能不全のために体自身の組織を攻撃する病気です。
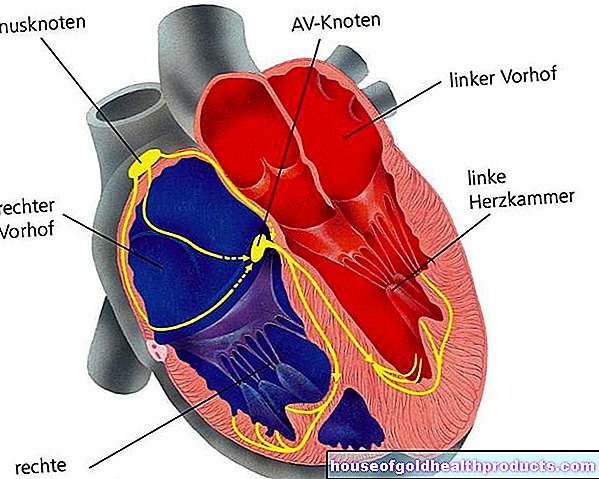
MSの場合、攻撃は中枢神経系に対して向けられます。防御細胞(特にTリンパ球だけでなくBリンパ球)は、神経細胞の領域に炎症を引き起こします。炎症性損傷は主に神経線維を含む白質に影響を及ぼします。しかし、特に病気が進行するにつれて、灰白質も損傷を受ける可能性があります。ここに神経細胞体があります。
多発性硬化症では、影響を受けた神経細胞プロセスは通常、白質のミエリン鞘を失います。これらの「シース」は、脳内の個々の神経線維と脊髄をセクションで囲みます。それらは電気絶縁として機能し、同時に励起のより速い伝導を可能にします。
専門家は、MSでは、とりわけ、ミエリン鞘の表面にある特定のタンパク質が自己抗体によって攻撃されていると想定しています。このようにして引き起こされた炎症過程は、脱髄または脱髄として知られているミエリン鞘を徐々に破壊します。神経突起自体(軸索)も損傷しています。研究者はまた、神経細胞の伸長が場合によっては直接損傷を受ける可能性があることを発見しました。ミエリン鞘はまだ無傷です。
神経細胞の比較-健康な神経細胞とMS神経細胞
時間が経つにつれて、MS患者はミエリン損傷とそれに続く瘢痕(硬化症)を伴う脳と脊髄の多数の(複数の)領域を発症します。これらの領域はプラークと呼ばれます。
影響を受けた神経線維はもはや神経信号を適切に伝達することができません-神経障害が発生します。これらは非常に多様である可能性があります-CNSのどこで炎症の病巣が発生するかによって異なります。そのため、多発性硬化症は「播種性脳脊髄炎」とも呼ばれます。 「disseminata」という言葉は「散在」を意味し、「脳脊髄炎」という言葉は病気の基本的なプロセスを指します。「Enkephalos」は脳を表し、「myelon」は脊髄を表し、最後の「-itis」は「炎症」を表します。
MSで自己免疫反応を引き起こすものは何ですか?
しかし、なぜ免疫系がMSで非常に混同されて、それ自体の神経組織を攻撃するのでしょうか。専門家は確かに知りません。おそらく、影響を受けた人々にはいくつかの要因が一緒になって、一緒に病気を引き起こします(病気の多因子発症)。さまざまな要因の正確な相互作用はまだ明らかにされていません。専門家は現在、特定の環境要因が病気の発生につながる可能性があることに基づいて、遺伝的素因を想定しています。
遺伝的要因
さまざまな観察結果は、多発性硬化症の発症における遺伝的要素を示唆しています。
一方では、多発性硬化症は一部の家族でより頻繁に発生します:MS患者の一等親血縁者(例えば、母、息子)は慢性神経疾患を発症するリスクも高くなります。
一方、特定の遺伝的星座は、MSの発生に関連しているようです。ここでの焦点は、特にヒト白血球抗原(HLA)にあります。それらは免疫系で役割を果たします。これまで多発性硬化症に関連していた他のすべての遺伝的危険因子も免疫系の遺伝子です。
ある程度、多発性硬化症は遺伝する可能性がありますが、遺伝するのは病気そのものではなく、MSを発症する傾向です。専門家は、病気の発生は他の要因(特に感染症などの環境要因)と関連してのみ発生する可能性があると考えています。
感染症
感染症(特にウイルスや細菌)は、多発性硬化症の発生に関与している可能性があります。対応する情報は、ファイファーの腺熱を引き起こすヘルペスウイルスの代表であるエプスタインバーウイルス(EBV)で特に利用可能です。
EBV(または他の病原体)による感染がMSの発症にどの程度正確に寄与するかはまだわかっていません。一般に、感染に対する免疫系の反応が、素因のある人々の多発性硬化症の発症を引き起こす可能性があります。
ライフスタイルと環境
環境要因または特定のライフスタイル要因も、多発性硬化症の発症に関与している可能性があります。しかし、「悪い」不健康なライフスタイルだけでは、多発性硬化症を引き起こすことはできません。
喫煙は多発性硬化症の重要な環境要因のようです。喫煙者は、非喫煙者よりも多発性硬化症を発症するリスクが高くなります。さらに、ニコチンの消費は病気の経過を悪化させるようです。
科学者たちはまた、多発性硬化症の潜在的な危険因子として、ビタミンD(「太陽のビタミン」)の不足について議論しています。この疑いは、MSと地理的緯度の間に明らかに関係があるという観察に基づいています。赤道から離れるほど(北極または南極の方向に)、集団で多発性硬化症がより頻繁に発生します。これは、日光への露出が減少していることが原因である可能性があります。赤道から離れるほど、日光への露出が弱くなり、皮膚に当たる太陽が少なくなるほど、皮膚で生成されるビタミンDが少なくなります。
その他の要因
性別も明らかに病気の発症に関与しています。女性は男性よりも多発性硬化症になる可能性が高くなります。なぜそうなるのかはまだわかっていません。
研究によると、高脂肪の「西洋型」食とそれに伴う肥満が多発性硬化症のリスクを高めることがわかっています。多発性硬化症の発症に影響を与える可能性のある他の要因は、食卓塩と腸内細菌叢の摂取量の増加です。
民族的所属も影響を及ぼしているようです。たとえば、多発性硬化症は他の民族グループよりも白人の間でかなり一般的です。たとえば、米国に住む黒人男性は、米国の白人男性よりも多発性硬化症を発症する可能性は低くなりますが、アフリカの黒人男性よりも頻繁に発症します。ここでも、地理的な緯度の影響が影響しているようです。
-
多発性硬化症に関する質問
の3つの質問
博士med。 Susanne Reicherzer、
神経内科医 -
1
なぜ誰かがMSを取得するのですか?
博士med。スザンヌ・ライヘルツァー
多くの科学研究プロジェクトにもかかわらず、本当の原因はまだ完全には理解されていません。この調査では、複数の因果関係があることを前提としています。遺伝的素因や環境要因などの要因について説明します。
-
2
再発の原因は何ですか?
博士med。スザンヌ・ライヘルツァー
エピソードの文脈における神経学的症状は、通常、亜急性、つまり事前の通知なしに発生します。通常、特定のトリガーを絞り込むことはできません。症状は、以前の感染やその他のストレス要因によって引き起こされることがあります。
-
3
あなたは一生薬を服用する必要がありますか?
博士med。スザンヌ・ライヘルツァー
病気の重症度によっては、予防のために薬を服用するのが理にかなっています。原則として、効果的な予防法を確立するために、薬は長期間、つまり何年も服用されます。優れたスペシャリストを見つけて、アドバイスとサポートを依頼してください。これは、個々のニーズを満たすための最良の方法です。
-
博士med。 Susanne Reicherzer、
神経内科医医師はミュンヘンで神経学、精神医学、心理療法の専門医を務めています。
多発性硬化症と一緒に暮らす
慢性で深刻な病気として、多発性硬化症は患者とその家族に多くの課題をもたらします。この病気は、パートナーシップ、セクシュアリティ、家族計画から社会生活や趣味、教育や仕事に至るまで、人生のあらゆる分野に影響を与える可能性があります。
多発性硬化症の子供ができますか? MSにもかかわらず休暇旅行は可能ですか?自分の上司に病気について知らされるべきか、それとも知らされるべきではないでしょうか?どの仕事が安く、どれがより不利ですか?これらおよび他の多くの質問はMS患者に関係しています。
多発性硬化症が影響を受ける人々の日常生活にどのように影響するか、そしてそれをどのように扱うかについての詳細は、多発性硬化症のある生活の記事で読むことができます。
多発性硬化症:検査と診断
多発性硬化症の診断は簡単ではありません。一方で、症状は非常に多様です。一方、MSでのみ発生する症状はありませんが、ほとんどの苦情には他の原因(脳の循環障害など)もある可能性があります。
MSは除外の診断です:「多発性硬化症」の診断は、発生する症状または臨床検査所見(CNSの炎症の空間的に分布した病巣など)についてより良い説明が見つからない場合にのみ行うことができます。
これを明確にするためには、さまざまな調査手順が必要です。以下が必要または可能です。
- 病歴調査
- 神経学的検査
- 磁気共鳴画像法(MRI)
- 神経水の検査(酒の診断)
- 神経生理学的検査(誘発電位)
- 血液と尿の検査
病歴に加えて、磁気共鳴画像法とCSF診断は、多発性硬化症の可能性を明らかにするために特に重要です。それらの結果は、マクドナルド基準に基づいたMSの診断を可能にします-それらはそれらの導入以来数回改訂されました。これらの懸念は、とりわけ、再発の数(再発性疾患の進行の場合)およびCNSにおける炎症の病巣である。
場合によっては、神経生理学的検査(誘発電位)も有用です。血液検査と尿検査は、主に神経系の症状や炎症の他の原因を除外するために使用されます。
多発性硬化症が疑われる場合の最初の連絡先はかかりつけの医師です。必要に応じて、彼はあなたを専門医、通常は神経内科医に紹介します。
病歴
多発性硬化症の診断に向けた最初のステップは、あなたの病歴(既往歴)を収集するために、医師とあなた、つまり患者との間の詳細な話し合いです。医者は、例えば、尋ねます:
- 正確にどのような苦情がありますか?
- 個々の症状に最初に気づいたのはいつですか?
- 症状は最初から何らかの形で変化しましたか(たとえば、その間に着実に増加または減少しましたか)?
- あなたまたはあなたの近親者は自己免疫疾患に苦しんでいますか?
- あなたの家族は多発性硬化症の症例を持っていますか?
覚えている苦情について医師に伝えてください。たとえ無害だと思っていたり、症状が治まったと思っていても。多発性硬化症の最初の兆候として、数か月または数年前の症状を特定できる場合があります。たとえば、MS患者の中には、腕や脚に数日から数週間「奇妙な感覚」があったことを覚えている人もいます。これは、脊髄の炎症の焦点を示している可能性があります。
性機能障害や膀胱や腸を空にすることの問題について話すことを恐れないでください。この情報は医師にとって重要です!あなたの説明がより完全で正確であるほど、彼は多発性硬化症が実際にあなたの症状の原因であるかどうかをより速く評価することができます。
神経学的検査
既往歴の議論に続いて、詳細な身体神経学的検査が行われます。その主な目的は、脳と神経の機能をチェックすることです。焦点は次のとおりです。
- 目と脳神経の機能
- 触覚、痛み、体温
- 筋力と筋緊張
- 調整と動き
- 膀胱、直腸、性器の神経伝導の相互作用
- 反射神経(例えば、腹部反射神経の欠如は多発性硬化症の一般的な兆候です)
さまざまなパラメータが決定され、標準化された方法で文書化されます。 「拡張障害ステータススケール」(EDSS)がよく使用されます。この尺度を使用して、歩行距離の観点から多発性硬化症および8つの機能システム(小脳、脳幹、視覚障害など)の障害の程度を体系的に記録できます。
多発性硬化症の神経学的欠損の別の評価システムは、多発性硬化症機能複合スケール(MSFC)です。医師は、たとえば、時間に基づくブレッドボードテスト(「9ホールペグテスト」)と時間に基づく短い歩行距離(「時限25フィート歩行」)による腕の機能のテストを行います。
磁気共鳴画像法(MRI)
多発性硬化症が疑われる場合、磁気共鳴画像法(MRI)は非常に重要です。検査の開始時に静脈に注入される造影剤の助けを借りて、脳および/または脊髄の活発な炎症病巣をMRI画像で見ることができます。
再発性MSの場合、診断基準では、これらの炎症の病巣が空間的および時間的に分散(播種)しているように見える必要があります。つまり、CNSの複数の場所に炎症の病巣が存在する必要があり、この種の新しい病巣が発生する必要があります。病気の経過。
2番目の基準-すなわち、炎症病巣の時間的広がり(時間的播種)-は、MRIによる対応する画像クレジットによって満たされると見なされるだけではありません。代わりに、神経水中の特定のタンパク質パターンを示すだけで十分です(酒の診断-以下を参照)。
患者が神経疾患の臨床症状を示さずに磁気共鳴画像法を使用してMSに典型的なCNSの変化を検出できる場合、これは放射線学的孤立症候群(RIS)と呼ばれます。多発性硬化症ではありません!
CSF診断
「多発性硬化症」の診断への道のもう一つの重要なステップは、神経液(液体)の検査です。これを行うために、医師は神経液の少量のサンプルを採取するために、局所麻酔下で細い中空針で脊柱管を注意深く突き刺します(腰椎穿刺)。それは実験室でより詳細に分析されます(酒の診断):
多発性硬化症で発生するような中枢神経系の慢性炎症プロセスは、神経水中のさまざまな異常を引き起こします。これには、特定のタンパク質パターン、いわゆるオリゴクローナルバンド(OKB)の検出が含まれます。
CSF診断は、神経系の炎症が多発性硬化症ではなく細菌(ライム病の病原体など)によって引き起こされている可能性があるかどうかを明らかにするためにも使用できます。
神経生理学的検査
神経生理学的検査は、中枢神経系の臨床的に検出できない損傷を検出し、既存の症状を客観的に記録するのに役立ちます。これは、いわゆる誘発電位を介して可能です。これらは、中枢神経系への興奮の伝達についての声明を出すことを可能にします。
これを行うために、医師は特定の神経路が特異的に刺激されたときに発生する電圧差を測定します。検出は、電極、通常はEEG(脳波)によって実行されます。以下の誘発電位は、MS診断の文脈で役立つ可能性があります。
>>視覚誘発電位(VEP):脳の視覚経路を評価するために、網膜が刺激されます。これを行うには、モニターのチェッカーボードパターンを確認します。たとえば、フィールドが次々と明るさの異なるものとしてすばやく表示されます。その間、このようにトリガーされ、視神経と視覚経路を介して伝達される電位は、頭の電極を介して記録および記録されます。
>>体性感覚誘発電位(SSEP):医師は電流を使用して、皮膚の敏感な神経(触覚など)を刺激します。
>>運動誘発電位(MEP):特別な磁気刺激装置が、特定の筋肉のけいれんを引き起こすために、CNSの運動神経路を刺激します。取り付けられた電極は、このモーター応答を測定します。刺激と運動反応の間に経過する時間は、テストされた神経路の機能状態に関する情報を提供します。ここでは磁場を使用して神経を刺激するため、医師は経頭蓋磁気刺激についても話します。
>>音響誘発電位(AEP):この測定は、多発性硬化症にも役立ちます。サウンドはヘッドホンで再生されます。次に、医師は電極を使用して、これらの音響刺激が脳に伝達される速度を測定します。
血液と尿の検査
上記のように、血液検査と尿検査は、主に鑑別診断を明らかにするために、つまり中枢神経系の症状と炎症の他の考えられる原因を明らかにするために、MS診断の一部として実行されます。
とりわけ、以下のパラメータは、血液分析で興味深い場合があります。
- 全血球計算
- カリウム、ナトリウムなどの電解質
- C反応性タンパク質(CRP)
- 血糖
- 肝臓の値、腎臓の値、甲状腺の値
- 自己抗体=リウマチ因子、抗核抗体(ANA)、抗リン脂質抗体、ループス抗凝固因子など、体自身の組織に対する抗体
- ボレリア(ボレリア症の病原体)、梅毒トレポネーマ(梅毒の病原体)、HIVなどのさまざまな感染性病原体に対する抗体
尿検査は、多発性硬化症の疑いを明らかにするのにも役立ちます。
多発性硬化症の明確な診断を下すのに、数週間、数ヶ月、あるいは数年かかることもあります。 「1000の名前を持つ病気」の検索はパズルに似ています。より多くの部分(所見)が合わさるほど、実際にMSであることがより確実になります。
多発性硬化症:治療
多発性硬化症の治療法は、さまざまな柱に基づいています。
- 再発療法:これは、MS再発の急性治療、好ましくは糖質コルチコイド(「コルチゾン」)による治療を意味します。あるいは、血漿交換または免疫吸着と呼ばれる血液型洗浄が役立つ場合があります。
- コース変更療法(基礎療法、免疫療法):ここでは、特定の薬剤(免疫療法剤)の長期使用を通じて、多発性硬化症のコースに好影響を与えようとします。
- 対症療法:これには、さまざまなMS症状を緩和するための対策が含まれます。たとえば、理学療法や、必要に応じて、痛みを伴う筋肉のけいれんに対する抗けいれん薬が含まれます。
- リハビリテーションプロセス:多発性硬化症のリハビリテーションの目的は、影響を受けた人々が家族、職業、社会生活に戻れるようにすることです。
治療目標を達成するために、多発性硬化症の患者は多くの異なるセラピストや専門医によって治療されます。さまざまな医師(神経科医、眼科医、泌尿器科医、かかりつけ医など)に加えて、MSの治療チームには、たとえば、心理学者、理学療法士、作業療法士、言語療法士、看護スタッフ、および/またはソーシャルワーカーを含めることもできます。治療チームと治療計画をまとめるとき、患者の個々のニーズが決定的です。
多発性硬化症:再発療法
MSの再燃は、症状の発症後できるだけ早く開始する必要があります。選択される治療法は、「コルチゾン」(糖質コルチコイド、コルチコステロイド)の投与です。あるいは、血漿交換が特定の場合に行われる。
コルチゾン療法
標準として、多発性硬化症の再発療法では、高用量のコルチゾン療法(コルチゾンショック療法、コルチゾンパルス療法)が3〜5日間行われます。これを行う最も一般的な方法は、メチルプレドニゾロンを1日あたり500〜1000ミリグラムの用量で静脈内に直接(静脈内に)注入することです。コルチゾンは睡眠障害を引き起こす可能性があるため、朝の服用が望ましいです。
MS患者にコルチゾンの静脈内投与が不可能な場合は、コルチゾン錠に切り替えることができます。
コルチゾンサージ療法は、発作の期間を短縮し、症状の退行を促進することができます。それが不十分な場合、専門家は治療を増やす(エスカレートする)ことを推奨します:
超高用量のコルチゾンが最大2000mg /日で3〜5日間可能です。症状の重症度と期間に応じて、代替的またはその後、血漿交換または免疫吸着(以下を参照)を検討することができます。
副作用:
多発性硬化症に対するコルチゾンショック療法の考えられる副作用には、上記の睡眠障害に加えて、気分のわずかな変化、胃のむかつき、顔面紅潮、および体重増加が含まれます。
血漿交換または免疫吸着
いわゆる血漿交換(PE)または免疫吸着(IA)は、次の場合に検討できます。
- コルチゾンショック療法の終了後、神経学的機能障害の無効化が持続するか、
- 進行性の特に重度のMS発作は、コルチゾンショック療法中に発生します。
血漿交換またはIAは、血液型洗浄の一種です。特殊な装置を使用して、カテーテルを介して患者の体から血液を抜き取り、ろ過してから体に戻します。ろ過の目的は、MSの再燃中の炎症過程の原因となる免疫グロブリンを血液から除去することです。
血漿交換と免疫吸着の違い:
血漿交換では、非特異的血漿(それに含まれる免疫グロブリンを含む)が患者の血流からろ過され、タンパク質溶液に置き換えられます(アルブミン投与)。対照的に、免疫吸着では、特に炎症過程に関与する免疫グロブリンのみが患者の血液から「釣り上げ」られます。どちらの場合も、「血液洗浄」は数回繰り返されます。
方法の1つが他より優れているか、または両方がMS患者に等しく効果的であるかどうかは不明です。
血漿交換または免疫吸着は、専門のMSセンターに入院患者として実施する必要があります。これは、MS攻撃の発症後最初の6〜8週間で行う必要があります。しかし、科学的研究では、可能な限り最良の時期はまだ明らかにされていません。特定の状況下では、PE / IAは、たとえばMS患者に超高用量のコルチゾン注入が不可能な場合など、より早い時点で検討することもできます。
血漿交換(PE)または免疫吸着(IA)の副作用と合併症は、例えば次のとおりです。
- 血圧調節の障害
- 腎臓の損傷
- 血液塩(電解質)のバランスの乱れによって引き起こされるテタニー症状(=過度に興奮する筋肉による運動能力と感受性の障害、たとえば、筋肉のけいれん、うずき、その他の異常な感覚の形で)[PEを使用]
- 凝固障害[特にPEで]
- 出血傾向の増加など、おそらく必要な薬用「血液希釈」(抗凝固)の副作用と合併症
- アレルギー反応(例えば、PEで供給されたアルブミンまたは血液をろ過するために使用される膜)
- 大きなカテーテルの使用による機械的刺激または合併症(出血や血餅形成など)
- カテーテルアクセスの領域での感染症(「血液中毒」まで=敗血症)
- 非常にまれ:肺水腫/輸血関連の活動性肺不全[PE]
多発性硬化症:コース変更療法
コース変更療法(免疫療法、基礎療法、コース療法)は、いわゆる免疫療法剤の長期投与で構成されます。これらには、免疫系の活性を抑制する活性物質(免疫抑制剤)または免疫反応を特異的に変化させることができる活性物質(免疫調節剤)が含まれます。
免疫療法は多発性硬化症を治すことはできませんが、コースに有益な効果をもたらす可能性があります。これは、再発性MS、つまり再発性寛解型MS(RRMS)とアクティブな二次進行型MS(アクティブなSPMS)で最大の効果を示します。 「活動的」とは、中枢神経系における再発および/または新たなまたは拡大する炎症関連の損傷の発生を指す。これらの場合、MS免疫療法剤による治療は再発率を低下させ、再発によって引き起こされる進行性障害を打ち消すことができます。
非アクティブなSPMSおよび主に進行性のMS(PPMS)の場合、免疫療法の有効性は低くなります。特定の免疫療法剤の使用は、それでも役立つ場合があります。これについて詳しくは、以下をご覧ください。
免疫療法薬の種類
以下の免疫療法剤は、現在、多発性硬化症の治療に使用されています。
- ベータインターフェロン(ペグインターフェロンを含む)
- 酢酸グラチラマー
- フマル酸ジメチル
- テリフルノミド
- S1P受容体モジュレーター:フィンゴリモド、シポニモド、オザニモド、ポネシモド(スイスではMSの承認なし)
- クラドリビン
- ナタリズマブ
- オクレリズマブ
- オファツムマブ
- リツキシマブ(多発性硬化症には承認されていません)
- アレムツズマブ
- 他の免疫療法剤
個々の症例における適切なMS免疫療法剤の選択は、多発性硬化症の経過、疾患活動性、および以前の免疫療法治療など、多くの異なる要因に依存します。個々の要因も役割を果たします。たとえば、患者の年齢、薬に対する忍容性、特定の併発疾患または妊娠の有無などです。
多発性硬化症の現在の医療ガイドラインでは、MS免疫療法を3つの有効性カテゴリに分類しています-炎症活動の相対的な減少(再発率、MRIでの炎症活動、再発に関連する疾患の進行)に応じて。これらの有効性カテゴリーは、MS療法の以前のレベルのスキームに取って代わります。たとえば、高活性である可能性が低い再発寛解型MSでは、カテゴリー1の代表例(ベータインターフェロンやフマル酸ジメチルなど)が示されます。
以下に、さまざまな免疫療法剤の簡単な説明を示します。
ベータインターフェロン
ベータインターフェロン(インターフェロンベータも)はサイトカインのグループに属しています。これらは、とりわけ免疫反応を調節することができる、体内で自然に発生するシグナルタンパク質です。多発性硬化症において薬物投与されたベータインターフェロンがどのように正確に機能するかはまだ明らかにされていません。
有効成分は注射器として使用されます-皮膚の下および/または筋肉内の準備に応じて。使用頻度も製剤によって異なります。ほとんどの製剤は、MS患者に週に1回または数回注射する必要があります。含まれているベータインターフェロンはポリエチレングリコールと結合しているため、2週間ごとに注射するだけでよい製剤も利用できます。このペグインターフェロンは、ペグ化されていないインターフェロンよりも作用時間が長くなります。
副作用:最も一般的なのは、特に治療の開始時のインフルエンザのような症状です(例:頭痛、筋肉痛、悪寒、発熱)。ただし、予防策は、治療法を「こっそり」(ゆっくりと用量を増やして)、夕方に注射を行うことです。さらに、注射の30分前に抗炎症性パラセタモールまたはイブプロフェンを服用すると、インフルエンザのような症状を打ち消すことができます。
皮膚の下に(皮下に)配置されるベータインターフェロン注射では、赤み、痛み、かゆみから局所的な炎症や組織の死(壊死)まで、注射部位で反応が起こる可能性があります。
うつ病の病歴のある多発性硬化症患者では、ベータインターフェロンによる治療がうつ病を悪化させる可能性があります。
インターフェロン療法を受けている患者は、好中球と血小板の欠乏、およびトランスアミナーゼの高い血中値をしばしば発症します。
さらに、薬剤に対して持続する中和抗体は、ベータインターフェロン治療中に発生する可能性があり、その結果、薬剤の効果が低下する可能性があります。
酢酸グラチラマー
酢酸グラチラマー(GLAT)も免疫調節剤です。その作用機序は正確にはわかっていません。さまざまなメカニズムについて説明します。とりわけ、GLATは制御性T細胞(リンパ球のサブグループ)の発達を促進する可能性があります。
GLATは、投与量に応じて、1日1回または週3回皮下注射されます。
副作用:GLAT注射は、注射部位で局所反応(発赤、痛み、膨疹、かゆみ)を引き起こすことがよくあります。多くの場合、美容的に不快な局所脂肪萎縮症、すなわち、へこみとして現れる皮下脂肪組織の局所的喪失があります。
GLAT製剤の承認研究では、患者の15%が、GLAT注射の直後に少なくとも1回、血管拡張、胸痛、息切れ、または動悸を伴う全身に影響を与える(全身)注射後反応を発症しました。
フマル酸ジメチル
フマル酸ジメチル(DMF)には、免疫調節作用と抗炎症作用があります。その正確な作用機序はまだ完全には理解されていません。これまでのところ、フマル酸ジメチルは、とりわけ、炎症性サイトカインの形成を減少させることが知られています。また、神経細胞とミエリン鞘を保護する効果もあります(神経細胞とミエリンを保護します)。
有効成分は1日2回カプセルとして服用します。
副作用:ほとんどの場合、DMFの摂取は、かゆみ、熱感または「紅潮」(熱感を伴う皮膚の突然の発赤)、胃腸の愁訴(下痢、吐き気、腹部の痛みなど)および欠乏症を引き起こしますリンパ球の(リンパ球減少症)。これらの重要な免疫細胞の減少は、人々を感染症にかかりやすくします。
ごくまれに、いわゆる進行性多巣性白質脳症(PML)になる可能性があります。2020年の終わりまでに、DMF療法を受けている11人の多発性硬化症患者がこの生命を脅かす脳のウイルス性疾患を発症しました。 PMLはJCウイルスによって引き起こされ、予後は不良です。免疫系が損なわれている場合、それを発症するリスクが存在します。これは、投薬(DMFなど)または癌やエイズなどの病気によって引き起こされる可能性があります。
フマル酸ジメチルを服用している患者は、帯状疱疹を発症する可能性も高くなります。タンパク尿のリスクも高くなります-尿中のタンパク質の排泄が増加します。
テリフルノミド
テリフルノミドには免疫抑制作用があります。これは、特にリンパ球において、細胞増殖、つまり細胞の急速な成長に重要な酵素の形成を阻害します。これらの白血球は、多発性硬化症の異常な免疫反応に関与しています。
MS患者はテリフルノミドを1日1回錠剤として服用します。
副作用:テリフルノミドは、特定の肝臓値(とりわけALTを含むトランスアミナーゼ)、頭痛、薄毛、下痢、吐き気の増加を引き起こすことがよくあります。
テリフルノミド療法の典型的な効果は、白血球が約15%減少し、血小板が最大10%減少することです。さらに、血球数の他の変化は、頻繁な副作用(好中球の欠如、貧血)として発生します。上気道や口唇ヘルペスなどの感染症も一般的です。
時折、手根管症候群などの末梢神経障害(末梢神経障害)がテリフルノミドで発症します。
フィンゴリモド
フィンゴリモドは、いわゆるS1P受容体モジュレーターです。特別な受容体(スフィンゴシン-1-リン酸受容体)を遮断することにより、血中のリンパ球の数を減らします。その結果、リンパ節から血液に、さらには中枢神経系に入るリンパ球が少なくなり、多発性硬化症の病気の進行に関与します。
有効成分は1日1回カプセルとして摂取されます。
副作用:記載されている作用機序により、リンパ球の欠如(リンパ球減少症)が典型的な治療効果です。
最も深刻な副作用には、房室ブロックとして現れる可能性のある心臓の伝導障害が含まれます。したがって、患者はECGモニタリング下で最初のフィンゴリモドカプセルを服用する必要があります。これは、誰かがフィンゴリモドの使用を1か月以上中断し、現在も継続したい場合にも当てはまります。
フィンゴリモド下の感染症も深刻な場合があります。インフルエンザや副鼻腔の感染症が非常に一般的で、気管支炎、ふすま菌(皮膚真菌の一種)、ヘルペス感染症が一般的です。クリプトコッカスによって引き起こされる髄膜炎などのクリプトコッカス症(真菌感染症)も観察されることがあります。
フマル酸ジメチルと同様に、フィンゴリモドを伴うJCウイルス関連脳疾患、すなわち進行性多巣性白質脳症の症例もいくつかありました(フィンゴリモドで治療された307,000人以上のMS患者で2020年8月末までに40症例)。
黄斑浮腫は、フィンゴリモドの深刻ですが時折の副作用です。この眼疾患は、治療せずに放置すると失明につながる可能性があります。
フィンゴリモド療法の別の望ましくない影響は、特定の癌腫瘍のリスクの増加です。たとえば、基底細胞癌(白い皮膚癌の形態)および時折黒い皮膚癌(悪性黒色腫)がフィンゴリモドとともに発症することがよくあります。
一般的な副作用は、肝酵素の増加でもあります-時には関連する肝障害の兆候です。
さらに、フィンゴリモドでは、可逆性後頭葉脳症症候群(脳の腫れを伴う神経疾患)、血球貪食症候群(制御不能な過剰免疫反応を伴う疾患)、および多発性硬化症の非定型経過の個々の症例がありました。
シポニモド
フィンゴリモドと同様に、シポニモドはスフィンゴシン-1-リン酸受容体モジュレーター(S1P受容体モジュレーター)であり、MS療法の承認を受けています(ただし、活動性二次進行型MSの治療のみ-以下を参照)。
シポニモドは毎日錠剤の形で服用されます。
治療を開始する前に、患者の遺伝子検査が必要です。体内の有効成分の代謝に影響を与える遺伝的要因が決定されます。検査の結果は、siponimodがどのように投与されるか、またはそれがまったく与えられるかどうかを決定するために使用されます。
副作用:それらは、フィンゴリモドの場合とシポニモドの場合で有意差はありません(房室ブロック、黄斑浮腫、感染のリスクの増加などの心臓の副作用)。
オザニモッド
Ozanimodは、MS療法に使用できるもう1つのS1P受容体モジュレーターです。 1日1回カプセルとして服用します。
副作用:繰り返しますが、副作用は一般的にフィンゴリモドと同じです。ただし、特定の望ましくない影響はozanimodではあまり一般的ではありません。異常に上昇した肝酵素に加えて、これには、例えば、AV閉塞も含まれます。したがって、フィンゴリモドとは対照的に、オザニモドの初回投与は、特定の心臓病の多発性硬化症患者の医師が監視する必要があるだけです。
ポネシモッド
2021年5月、4番目のS1P受容体モジュレーターがEUの多発性硬化症治療での使用が承認されました:ponesimod。このクラスの有効成分の他の代表者のように、それは1日1回服用されます。
副作用:最も一般的な副作用には、上気道感染症、肝酵素の増加、高血圧などがあります。その他の望ましくない影響には、尿路感染症や息切れ(呼吸困難)などがあります。
クラドリビン
クラドリビンは、ある種の血液がん(有毛細胞白血病)を治療するために(注射用の溶液として)最初に開発された免疫抑制剤です。数年前、多発性硬化症治療薬として承認されました。有効成分は、主にさまざまなメカニズムでリンパ球の細胞死(アポトーシス)を引き起こします。
多発性硬化症のクラドリビン療法は、2年間にわたる2つの療法サイクルで構成されています。 1年に2つの短期摂取段階があります。2か月連続で、患者は1つまたは2つのクラドリビン錠をそれぞれ4〜5日に服用します。
副作用:クラドリビン錠による治療は、リンパ球の不足(リンパ球減少症)を引き起こすことがよくあります。好中球の数が減少することがよくあります。帯状疱疹も、特にリンパ球の不足に関連して、より一般的です。
重篤な感染症は、プラセボ群よりもクラドリビンを服用しているMS患者の研究でもより頻繁に発生しました(プラセボ=クラドリビンの代わりにダミー薬を投与された比較患者)。個々のケースでは、そのような感染症は死に至りました(結核患者の約3人に1人)。
さらに、クラドリビン療法を受けている患者の臨床試験と長期追跡調査により、これらの患者はプラセボ治療を受けた患者よりも癌性腫瘍を発症する可能性が高いことがわかりました。
ナタリズマブ
遺伝子操作された抗体ナタリズマブは、特にリンパ球において、細胞表面の特別なタンパク質をブロックします。その結果、免疫細胞は中枢神経系に移動できなくなり、そこで多発性硬化症に典型的な炎症を引き起こします。
通常、ナタリズマブは4週間ごとに点滴として投与されます。
副作用:最も一般的な副作用は、尿路感染症、鼻咽頭炎、頭痛、めまい、吐き気、倦怠感(過度の疲労感)、関節痛です。じんましん(じんましん)、嘔吐、発熱がしばしば発症します。時折、薬に対する重度のアレルギー反応が観察されます。
進行性多巣性白質脳症(PML)を発症するリスクには特に注意を払う必要があります。 2020年8月末までに、この脳の危険なウイルス性疾患の800例以上がナタリズマブを服用している患者に登録されました。そのため、この有効成分の使用は慎重に検討され、綿密に監視されています。
ナタリズマブ療法から生じる可能性のある別のまれな感染性合併症は、ヘルペスウイルス関連感染症です。
オクレリズマブ
オクレリズマブも遺伝子操作された抗体であり、いわゆる抗CD20抗体の1つです。Bリンパ球の特定の表面タンパク質(CD20)に結合し、それらを溶解させます。 Bリンパ球は、多発性硬化症における神経鞘(ミエリン鞘)の損傷と神経細胞プロセスに関与しています。
それは注入の形で使用されます。治療は、14日ごとに300mgのオクレリズマブを2回注入することから始まります。その後、MS患者は6ヶ月ごとに600mgの注入を受けます。
副作用:言及されている最も一般的な副作用は、注入反応です(例:かゆみ、発疹、吐き気、嘔吐、頭痛、発熱、悪寒、血圧のわずかな上昇または低下)。それらは通常穏やかです。
最近オクレリズマブに切り替えた患者では、進行性多巣性白質脳症(PML)の数例が観察されています。これらのほとんどは、以前にナタリズマブで治療されていました(上記を参照)。
原則として、抗CD-20抗体による治療中は、日和見感染症(=免疫系の障害の結果として発生する感染症)および感染症が治癒した後のB型肝炎ウイルスの再活性化に注意を払う必要があります。
オファツムマブ
オファツムマブは別の抗CD20抗体です。多発性硬化症の患者は、事前に充填されたペンを使用して、皮膚の下に活性物質を注射することができます。治療は7日間隔で3回の注射で開始されます。 1週間の休憩の後、次の注射が続き、4週間ごとに別の注射が続きます。
副作用:オファツムマブの最も一般的な副作用には、上気道感染症、尿路感染症、注射部位での局所反応(発赤、痛み、かゆみ、腫れ)、および全身の注射関連反応(発熱、頭痛、筋肉痛)が含まれます。 、寒気、疲れ)。
上記のように、すべての抗CD20抗体には、日和見感染が発生したり、治癒したB型肝炎感染が再び再発したりするという一般的なリスクがあります。
リツキシマブ
リツキシマブは抗CD20抗体でもあり、多発性硬化症の治療に使用されることもありますが、この適用分野では承認されていないため(EUでもスイスでも)、ここでは「適応外」で使用されます。
リツキシマブの使用、副作用、相互作用について詳しくは、こちらをご覧ください。
アレムツズマブ
アレムツズマブは、リンパ球の特定の表面タンパク質(CD52)に対して向けられた別の遺伝子操作された抗体です。このタンパク質に結合することにより、免疫細胞の破壊を引き起こします。
有効成分は注入として投与されます-最初の年は5日連続で、1年後は3日連続で投与されます。必要に応じて、アレムツズマブは、前の投与から少なくとも12か月離れて、3日連続で3回目と4回目に投与することもできます。合計で、最大4つの治療サイクルが可能です。
副作用:アレムツズマブは、注入反応(頭痛、皮膚反応、発熱、嘔吐など)、感染症(ヘルペスウイルスなど)、および自己免疫性甲状腺疾患を引き起こすことがよくあります。一般的な副作用は、まれな自己免疫疾患であるITP(特発性血小板減少性紫斑病)です。時折、多発性硬化症の患者は治療中に白血球数と赤血球数の障害を発症します。自己免疫性腎疾患はまれです。
新しい、時には深刻な副作用が知られるようになった後、アレムツズマブの使用は制限され、特定の予防措置に関連付けられました。これらの副作用は、これまで主にアレムツズマブ注入の1〜3日後に発生した、新しい免疫介在性疾患(自己免疫性肝炎、血友病Aなど)および急性心血管系副作用(心臓発作、脳卒中、肺出血など)です。
その他の免疫療法剤
>>アザチオプリン:この免疫抑制剤は、さまざまな疾患の治療に承認されています。EU(スイスではありません)などで、多発性硬化症の治療に使用されています。ただし、研究状況が悪いため、例外的な場合にのみ使用する必要があります。たとえば、MS患者がアザチオプリンで十分に治療できる疾患(クローン病など)にも苦しんでいる場合などです。アザチオプリンの効果、使用法、副作用について詳しくは、こちらをご覧ください。
>>ミトキサントロン:免疫抑制作用のあるこの薬は、多発性硬化症の治療薬としてEUとスイスで承認されています。研究状況が悪く、毒性が高いため、例外的な場合にのみ予備薬として投与する必要があります。その最も深刻な副作用には、心臓の損傷や血液がん(白血病)のリスクの増加が含まれます。
>>メトトレキサート:有効成分は、さまざまな病気の抗炎症および免疫抑制剤として低用量で使用されます。ただし、多発性硬化症の治療には承認されていません。ただし、メトトレキサートがMSで投与されることはめったにありません。有効性のエビデンスが不十分で承認がないため、これはメトトレキサートによる治療が必要な疾患にも苦しんでいる多発性硬化症患者にのみ推奨されます。この有効成分について詳しくは、こちらをご覧ください。
>>シクロホスファミド:この免疫抑制剤は、多発性硬化症のまれなケースでも使用されますが、承認されておらず、この疾患での有効性は十分に証明されていません。ここでもメトトレキサートと同じことが当てはまります。シクロホスファミドは、この有効成分で治療しなければならない2つの病気を患っているMS患者にのみ投与する必要があります。シクロホスファミドの詳細については、こちらをご覧ください。
一次進行性MS(PPMS)の免疫療法
現在まで、主に進行性の多発性硬化症の治療薬として承認されているのは、オクレリズマブの1つだけです。現在のガイドラインによると、多発性硬化症がまったく承認されていない場合でも、リツキシマブを使用することもできます。ここでは「適応外使用」(=承認外)で使用されています。
高齢の患者では、これら2つの抗CD20抗体の有効性は低下しますが、合併症の発生率は高くなります。したがって、ガイドラインによると、50歳以上のPPMS患者では、特にMRIで中枢神経系の炎症活動が見られない場合は、オクレリズマブまたはリツキシマブの使用を慎重に検討する必要があります。
ただし、個々のケースでは、患者の障害の程度が急速に増加し、独立性を失う恐れがある場合は、この年齢層(2歳に制限)でも免疫療法を試みることができます。
二次進行型多発性硬化症(SPMS)の免疫療法
効果的な免疫療法剤は現在、アクティブなSPMS、つまりMRIで再発または新たな炎症性神経損傷を伴う二次進行型MSでのみ利用可能です。ガイドラインによると、シポニモド、ベータインターフェロン、クラドリビン、および抗CD20抗体であるオクレリズマブとリツキシマブを罹患患者に考慮することができます。これらの有効成分を用いた免疫療法を支持する議論は、例えば、若い年齢、短期間の病気、および低度の障害である。
ミトキサントロンは、有効成分がかなりの副作用を引き起こす可能性があるため、有効成分を伴う例外的な場合にのみ投与する必要があります(上記を参照)。
原則として、免疫療法は、SPMSが不活性な未治療の患者では開始すべきではありません。抗CD20抗体の1つによる治療は、障害が急速に増加し、独立性を失うリスクがある場合にのみ、個々のケースで試みることができます(最初は2年に制限されています)。そのような治療が役立つという証拠はありませんが、そのような患者のための他の治療オプションはありません。
臨床的に孤立した症候群(HIS)の免疫療法
多発性硬化症の症状を伴う再燃を初めて経験した患者は、MSのすべての診断基準を満たさずに免疫療法を受ける必要があります。しかし、これまでのところ、このような臨床的に孤立した症候群(HIS)の治療に承認されているベータインターフェロンと酢酸グラチラマーはごくわずかです。
必要に応じて(患者を注意深く監視しながら)、軽度の経過をたどることができれば(たとえば、再発症状がわずかにしか現れないため)、HISの免疫療法を待つことができます。
免疫療法の期間
多発性硬化症の免疫療法を中止できる、または中止すべき時期は、研究でまだ十分に調査されていません。しかし、炎症性疾患の活動は、年齢や疾患の期間が長くなるにつれて低下する傾向があると考えられています。その結果、免疫療法の効果が低下します。さらに、多くの免疫療法剤による副作用のリスクは、患者が年をとるほど高くなります。
したがって、場合によっては、医師と患者は、一定期間後に免疫療法を中断することを共同で決定することができます。このような治療の中断は、ベータインターフェロンまたは酢酸グラチラマーを少なくとも5年間投与した後、たとえば、患者が低い疾患活動性(例:再発が少ない、MRIでの炎症活性が低い)のみを示し、治療が来ました。
ナタリズマブ、フィンゴリモド、オクレリズマブなどの他の免疫療法薬では、患者が疾患活動性を示さない場合は、治療の中止について個別に決定する必要があります。この質問に関する研究はありません。
アレムツズマブ(最大4治療サイクル)とクラドリビン(最大2治療サイクル)の治療期間は最初から制限されています。そのような治療の終了後に患者が疾患活動性を示さない場合、他の免疫療法剤を最初に投与すべきではありません。ただし、定期的な検査をお勧めします。
その他の治療法
数十年前、研究者たちは、自己免疫疾患の多発性硬化症は、自家幹細胞療法(自家造血幹細胞移植、aHSCT)で免疫系を「再開」することで治療できる可能性があるという考えを思いつきました。簡単に言えば、治療法は次のように機能します。
血液幹細胞は、MS患者の体から得られます-さまざまな血液細胞(リンパ球を含む)を生成する幹細胞。その後、患者の免疫系は薬(癌の化学療法で使用されるものなど)で破壊されます。次に、患者は以前に注入によって除去した幹細胞を受け取ります。次に、これらは新しい造血システムを構築し、それとともに新しい細胞性免疫システムを構築します。
aHSCTは、疾患活動性の高い多発性硬化症の再発に特に有用であると言われています。多発性硬化症における自家幹細胞移植に関するいくつかの研究は、現在、ドイツを含む世界中で進行中です。
ドイツ、オーストリア、その他のEU諸国では、aHSCTは現在MSの治療に承認されていませんが、他のいくつかの国(スウェーデンなど)では承認されています。スイスでは、aHSCTは、特定の条件を条件として、2018年にMS療法の承認を受けました。
多発性硬化症の場合、バランスの取れた食事が一般的に推奨されます(これまでのところ、特定の食事形態のプラスの効果の証拠はありません)。患者はまた、太りすぎや喫煙の悪影響にも注意する必要があります。
多発性硬化症の患者では、ビタミンDの不足が証明されている場合は、たとえばビタミンDサプリメントで補う必要があります。ビタミンD欠乏症がない場合は、このような準備をすることも検討できます。しかし、ビタミンDの摂取が多発性硬化症の経過にまだプラスの効果をもたらしていないことは患者にとって明らかなはずです。
専門家は、健康上のリスクを排除することはできないため、極端に高用量のビタミンD製剤(ビタミンD超高用量療法)に反対するようアドバイスしています。
多発性硬化症:対症療法
多発性硬化症は、さまざまな症状(膀胱機能障害、倦怠感、筋肉のけいれんなど)を引き起こす可能性があります。的を絞った対策は、これらの苦情を軽減し、影響を受ける人々の生活の質を向上させるのに役立ちます。したがって、対症療法は多発性硬化症療法の不可欠な部分です。医薬品に加えて、非医薬品(理学療法、作業療法、言語療法、心理療法など)も含まれます。ここではいくつかの例を示します。
理学療法
幅広い技術と方法を備えた理学療法は、たとえば次のような場合に、さまざまな多発性硬化症の症状に対抗するのに役立ちます。
痙性(しばしば痛みを伴う、病理学的に緊張した、硬い、窮屈な筋肉)は、多発性硬化症の一般的な症状です。定期的な理学療法はこれを防ぐのに役立ちます。したがって、それは痙性の非薬物治療の中心的な要素です(痙性を引き起こす要因を回避することに加えて)。
運動協調運動障害(運動失調)のある患者も、定期的な理学療法の恩恵を受けています。目的は、例えば協調的な歩行訓練/立ち上がることを通じて、協調を促進することです。
多発性硬化症が腸機能の障害(慢性便秘および/または便失禁)を引き起こす場合は、他の非薬物療法に加えて、骨盤底トレーニングを含む理学療法を試すことができます。
MS患者が自宅で理学療法士と一緒にトレーニングするさまざまなエクササイズ(骨盤底トレーニングや筋肉のけいれんに対するエクササイズなど)を定期的に実行することは、多くの場合理にかなっています。セラピストは、独立したトレーニングのための適切な指示を提供します。
作業療法
作業療法は、多発性硬化症の患者が外部の助けなしに日常生活に対処し、可能な限り独立した状態を維持できるようにすることを目的としています。すべてのエクササイズは、日常生活における患者のニーズに基づいています。
たとえば、作業療法は、理学療法に加えて、運動協調性の障害(運動失調)や不随意のリズミカルな振戦(振戦)に推奨されます。セラピストの助けを借りて、患者は、とりわけ、通常の省エネ運動を練習し、特に物体(カップなど)をつかむように訓練することができます。既存のハンディキャップで、患者はそれに対処し、「代替運動」に切り替えることを学びます。
必要に応じて、セラピストは、ウォーカーや手首のウェイト(手の震え)などの補助器具を使用するように患者を試し、訓練します。
作業療法は通常、体と脳の障害を元に戻すことはできません。しかし、それは影響を受けた人々が可能な限り長く独立したままでいるのを助けます。このため、多発性硬化症の人は、セラピストの有無にかかわらず、忍耐と練習が必要です。
症状の薬
必要に応じて、通常は非薬物療法に加えて、さまざまな多発性硬化症の症状を緩和するために薬物療法を使用することもできます。いくつかの例:
- 痙性に対する抗痙性薬(バクロフェン、チザニジンなど)
- 歩行障害のためのファンプリジン
- 過活動膀胱に対する抗コリン作用薬(例:塩化トロスピウム、トルテロジン、オキシブチニン)
- 夜間頻尿(夜間頻尿)/頻尿(ほとんどが少量の尿のみ)(夜間頻尿)に対するデスモプレシン
- 鎮痛剤(鎮痛剤)、例:頭痛、神経痛
- 勃起不全(勃起不全)に対するPDE-5阻害剤(シルデナフィルなど)
- うつ病の気分に対する抗うつ薬(特にSSRI =選択的セロトニン再取り込み阻害薬)
多発性硬化症:リハビリテーション
対症療法は個々の多発性硬化症の症状を改善することを目的としていますが、リハビリテーションはそれ以上のものです。つまり、MS患者は日常生活に再び参加できるようになります。
この目的のために、例えば、日常の活動(例えば、歩くとき、服を着るとき、個人の衛生状態)における既存の障害を排除するか、少なくとも改善しようとする。脅迫的な障害(職場など)を避けたいと考えています。さらに、多発性硬化症のリハビリテーションは、患者の自立と移動を促進し、患者の社会的統合(家族、社会環境、仕事)を維持または改善することを目的としています。
したがって、MS患者は以下の状況でリハビリテーションを提供されるべきです:
- MS発作後の持続的で機能的に重大な障害の場合
- 病気の過程で重要な機能および/または独立性の喪失および/または身体的または心身機能障害のかなりの増加が脅かされる場合
- 社会的および/または専門的統合の喪失の脅威がある場合
- 機能的に影響の少ない人々の場合、病気への対処を支援し、病気の背景、必要な治療法、および可能な自助措置(心理教育)について構造化された方法で患者に知らせるために
- 明確に定義された治療目標と学際的アプローチの必要性を伴う重度障害のあるMS患者
マルチウィークおよびマルチモーダル
これらの目標を達成するためには、数週間続くマルチモーダルリハビリテーションが必要です。 「マルチモーダル」とは、リハビリテーションプログラムがさまざまなコンポーネントで構成されていることを意味します-各MS患者に個別に適応します。 MSリハビリテーションの一般的な構成要素は次のとおりです。
- 理学療法
- 作業療法
- 運動とトレーニング療法
- 言語療法
- 疾病管理技術
- 一般的なスキルを促進するための治療ケアの活性化
- トレーニングと情報(病気、治療法など)
外来または入院
原則として、MSのリハビリテーションは、適切なリハビリテーション施設で外来患者または入院患者ベースで可能です。個々のケースで決定的なのは、既存の障害の程度と個々のリハビリテーションの目標です。
十分に可動性があり、機能上の制限がわずかしかない人は誰でも、外来で定期的な機能療法を受けることができます。対照的に、中等度から重度の障害(特に運動が制限されている)のある多発性硬化症の患者には、入院患者のリハビリテーションが推奨されます。
多発性硬化症の専門クリニックでの治療も有用な場合があり、集中的なマルチモーダル療法も実施されます(MS複合治療)。これは、タイムリーに医学的に解明する必要がある、および/またはさらなる治療措置を必要とする複雑な症状および/または付随する疾患の場合です(例えば、脊柱管への直接のバクロフェンなどの薬物の投与=髄腔内)。
多発性硬化症:補完的および代替的な治癒方法
「補完的」および「代替的」な治癒方法は、明確に定義された用語ではありません。一般に、それらは、疾患の従来の(従来の医療)治療の補足(補完的手順)または代替(代替手順)と見なされます。
補完的および代替的な治癒方法は、多発性硬化症などの慢性疾患を持つ人々に特に関心を呼び起こすことがよくあります。ホメオパシー、漢方薬(植物療法)、鍼治療-多くの多発性硬化症患者は、これらの手順や他の手順に大きな期待を寄せています。
補完的および代替的な治癒方法(一般的または多発性硬化症)の有効性は、通常、科学的に証明されていません。一部の方法にはリスクも伴います。
したがって、多発性硬化症の患者は、従来の多発性硬化症の治療に加えて他の治癒方法(つまり補完的な方法)を使用したい場合は、常に最初に治療医と話し合う必要があります。ただし、従来の治療法を代替治療法に置き換えることはお勧めできません。
次の表に、多発性硬化症で使用される代替/補完的な手順の選択を示します。
|
方法 |
判定 |
|
鍼 |
MS療法に加えて(補完的に)非常に頻繁に使用されます。たとえば、痛みを和らげるためにそれを使用しようとすると便利です。 |
|
指圧 |
ここでも鍼治療と同じことが言えます。 |
|
アマルガム除去 |
詰め物から漏れる水銀は、MSの発症に関与していると言われています。これについての科学的証拠はありません。 |
|
特定の種類の栄養/食事 |
これまでのところ、MSの経過や症状にプラスの効果をもたらす栄養や食事の形態は示されていません。専門家は一般的に、新鮮な野菜、果物、魚、不飽和脂肪酸を多く含み、肉や脂肪はほとんど含まない、多様でバランスの取れた食事を推奨しています。 |
|
蜂毒療法(アピセラピー) |
ミツバチの毒は、体内の抗炎症プロセスを引き起こすと言われています。ただし、MSには有効性の科学的証拠はありません。重度のアレルギー反応のリスクもあります。したがって、危険であると見なされ、お勧めできません。 |
|
酵素の組み合わせ/酵素療法 |
病気の原因となる免疫複合体を分解する必要があります。しかし、大規模な研究では、MSでの有効性を証明できませんでした。 |
|
新鮮な細胞治療 |
重度のアレルギー(循環虚脱を含む)のリスクと感染のリスク。したがって、危険であると見なされ、お勧めできません。 |
|
ホメオパシー |
一部のMS患者によると、これにより、めまい、膀胱と腸の問題、集中力の問題、回復力の欠如、一般的な健康状態などの症状が改善されます。 |
|
免疫増強(免疫反応の増強) |
感染症、アレルギー、多発性硬化症の悪化のリスクがあります。したがって、それは危険であり、お勧めできません! |
|
髄腔内幹細胞療法 |
脊柱管への患者自身の幹細胞の注入。重篤から致命的な副作用のリスクを負います。したがって、それは危険であり、お勧めできません! |
|
ヘビ毒 |
重度のアレルギーのリスクがあります。したがって、危険であると見なされ、お勧めできません。 |
|
腹壁へのブタの脳移植 |
多発性硬化症を悪化させ、重度のアレルギー反応を引き起こし、死に至る可能性があります。したがって、それは危険であり、お勧めできません! |
|
太極拳 |
ゆっくりと意図的に運動すると、運動協調性の障害(運動失調)など、一部のMS症状にプラスの効果をもたらす可能性があります。 |
|
気功 |
漢方薬(TCM)の一部。エクササイズにはストレス解消とリラックス効果があり、MSセラピーがそれをサポートします。 |
|
酸素過圧療法(高圧酸素) |
MSの進行を止めることになっていますが、これは研究で証明されていません。 |
|
お香 |
抗炎症効果。たとえば、炎症性腸疾患や関節リウマチで良い結果が得られます。しかし、MSにおけるその有効性に関する研究はありません。 |
|
ヨガ |
さまざまな運動(運動、協調、リラクゼーションなど)は、痙性や倦怠感などの症状にプラスの効果をもたらす可能性があります。 |
多発性硬化症:予後
多発性硬化症の人の多くが遅かれ早かれ車椅子になってしまうという恐れは当てはまりません。改善された治療法のおかげで、多発性硬化症は現在、多くの患者で以前よりも有利な経過をたどっています。
多発性硬化症の予後が個々の症例でどのように見えるかは予測できません。ただし、いくつかの兆候があります。たとえば、次の要因は、病気のかなり不利な経過を物語っています:
- 男性の性別
- 後の発病
- 複数の症状を伴う発病
- 初期の運動症状(運動失調など)、小脳症状(意図振戦など)または括約筋症状(尿失禁などの括約筋症状)
- 再発症状の不完全な解決
- 高い推力周波数
一つ確かなことは、患者が専門的で一貫した治療と彼の社会環境の支援を受ければ、病気の経過はプラスの影響を受ける可能性があるということです。さまざまな治療法における患者の協力も同様に重要です。ただし、多発性硬化症の患者が野心的すぎて「多すぎる」ことを望んでいる場合、彼らの限られた力が消耗し、エネルギーの蓄えが時期尚早に使い果たされます。
追加情報
自助グループ:
ドイツの多発性硬化症協会:
https://www.dmsg.de/multiple-sklerose-infos/faq/wie-finde-ich-eine-selbsthilfegruppe/
オーストリア多発性硬化症協会:
https://www.msges.at/adressen-links-multiple-sklerose/ms-selbsthilfegruppen-in-oesterreich/
スイス多発性硬化症協会:
https://www.multiplesklerose.ch/de/unsere-angebote/selbsthilfegruppen/
本の推奨事項:
ジュリア・フービンガー:いつものように、いつものように何もありません:多発性硬化症の私のほぼ普通の生活、エデン・ブックス、2017年
タグ: ティーンエイジャー 代替医療 栄養





.jpg)