レムデシビル:EU当局は承認を推奨
FlorianTiefenböckは、LMUミュンヘンで人間医学を学びました。彼は2014年3月に学生としてhouseofgoldhealthproductsに参加し、それ以来、医療記事で編集チームをサポートしてきました。アウグスブルク大学病院で医師免許と内科の実習を受けた後、2019年12月からhouseofgoldhealthproductsチームの常任メンバーであり、とりわけhouseofgoldhealthproductsツールの医療品質を保証しています。
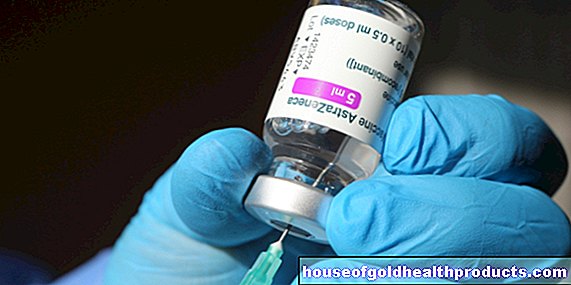
FlorianTiefenböckによるその他の投稿 すべてのhouseofgoldhealthproductsコンテンツは、医療ジャーナリストによってチェックされます。Sars-CoV-2コロナウイルスに対する適切な薬剤の探索は続けられています。現在、欧州医薬品庁(EMA)は初めて、条件付き承認のためにCovid19患者の治療薬であるレムデシビルを推奨しています。
木曜日の欧州医薬品庁(EMA)の公式声明によると、欧州医薬品庁はレムデシビル(商品名Veklury)の制限付き承認を推奨しました。したがって、レムデシビルは、12歳以上の成人および青年におけるCovid-19の治療薬として承認されることになっています。ただし、これは、影響を受けた人がSars-CoV-2から肺炎を発症し、追加の酸素が必要な場合にのみ適用されます。
EU委員会は、有効成分がこの承認の枠内で欧州市場に投入される前に、依然として勧告を承認する必要があります。プレスリリースによると、委員会は来週にこれを決定する予定です。
迅速承認
現在の推奨事項は、有効成分のいわゆる「条件付き承認」です。治療の必要性が特に高い場合に使用できますが、有効性と利点に関するデータは、通常必要な範囲でまだ利用できません。
4月30日以降、ヒト用医薬品委員会は、非臨床試験、研究、および思いやりのある使用プログラムから収集され、部分的に暫定的なデータを段階的に評価しています。それらは、現在推奨されている薬の製造業者である米国のバイオテクノロジー企業であるギリアド・サイエンシズによって提出されました。メーカーは6月5日に承認申請を提出しました。
現在推奨されている承認後、EMAは、年末までにレムデシビルの利点と安全性に関するさらなるデータをメーカーに要求しています。会社は8月末までに品質の証明だけでなく死亡率のデータも提出しなければなりません。
レムデシビルは誰を助けるべきですか?
その意見では、当局は主に米国アレルギー感染症研究所によって資金提供されたNIAID-ACTT-1研究に依存しています。専門家はまた、サポートとして他の研究からのデータを参照しました。
最終的に、彼らは、この薬がCovid-19に深刻な病気を患っている患者に有害であるよりも有益であるという結論に達しました。彼らは、肺炎を発症し、酸素の追加供給を必要とする人々を指します。
上記の研究では、合計1000人が調査されました。医師は、一方の研究グループの患者をレムデシビル(10日)で治療し、もう一方のグループの患者をプラセボで治療しました。レムデシビルで治療された患者は、プラセボ群の参加者よりも約4日早く回復したことがわかりました。
しかし、その効果は重症のCovid19患者にのみ見られました。回復時間は、軽度または中等度の疾患重症度の患者で同じままでした。これまでのデータによると、すでに換気されている患者や、いわゆる体外酸素化(ECMO)によって血液が酸素で強化されている患者でも、レムデシビル治療の効果はありませんでした。
以前の使用
レムデシビルはもともとエボラ熱を治療するために開発されました。 Covid-19薬として、これまで米国や日本などで使用されてきました。日本は5月の初めにメーカーギレアデを承認しました。ドイツでも、レムデシビルはEMAの推奨に従って投与されました。いわゆる思いやりのある使用プログラムの一環として重病の場合、関係者に他の治療オプションがなくなった場合。
タグ: 病気 家庭薬 喫煙